-
- 2023-06-06人人讲安全、个个会应急:我院启动2023年“安全生产…

- 2023-06-06一图了解欧宝app下载 “冬病夏治”活动

- 2023-06-02我院入选甘肃省首批“大思政课”实践教学基地

- 2023-06-02抓执行促落实 | 安全生产委员会对北院开展安全生产…

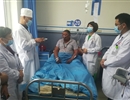
- 2023-05-31泰国皇太后大学代表团来我院交流访问
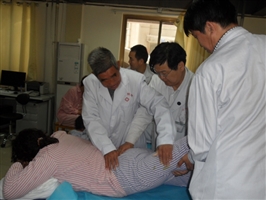
- 2023-05-29我院药学团队获得全省中药技能大赛团体一等奖
- 2023-05-26我院完成苹果欧宝软件下载安装 2018级实习生毕业考核工作
- 2023-05-26抓学习促提升 | 医院召开党委理论中心学习组专题学…
- 2023-06-06人人讲安全、个个会应急:我院启动2023年“安全生产…
-
- 2023-06-06抓执行促落实 | 苹果欧宝软件下载安装 主题教育第三指导小…

- 2023-06-02抓执行促落实 | 安全生产委员会对北院开展安全生产…

- 2023-05-31抓学习促提升 | 我院信息中心参加第三届卫生健康行…
- 2023-05-31抓学习促提升 | 我院“名医名师”大讲堂第三场讲座…
- 2023-05-26抓学习促提升 | 医院召开党委理论中心学习组专题学…
- 2023-05-22抓学习促提升 |上海中医药大学附属曙光医院元唯安教…
- 2023-05-15抓学习促提升 | 党委书记吴冰为联系支部讲党课
- 2023-05-12抓执行促落实丨我院口腔科在苹果欧宝软件下载安装 和平校区…
- 2023-06-06抓执行促落实 | 苹果欧宝软件下载安装 主题教育第三指导小…
-
- 2023-04-20新华社:中医使者的巴西情缘
- 2023-02-17兰州晨报:又是久坐惹的祸→马尾综合征听说过没?
- 2023-02-06新甘肃:欧宝app下载 与上海中医药大学附…
- 2022-12-30新华社:甘肃兰州 加紧生产中药制剂保障群众需求
- 2022-12-30新华全媒+:保障群众用药!这些举措暖心
- 2022-11-16中国中医药报:推动中医药守正创新 当好人民健康守…
- 2022-09-06甘肃经济广播:秋季干燥 银屑病进入高发期 医生教你…
- 2022-09-06甘肃经济广播:听专家讲“防秋燥”
-
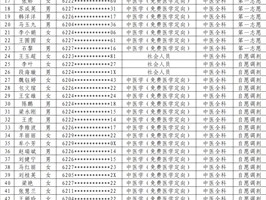
- 2023-05-20欧宝app下载 2023年中医(全科)住院医师…
- 2022-09-09关于公布2022年住院医师规范化培训及全科医师规范化…
- 2022-07-07欧宝app下载 2022年住院医师规范化培训招…
- 2021-08-16关于公布2021年住院医师规范化培训及全科医师规范化…
- 2021-07-06欧宝app下载 2021年住院医师规范化培训招…
- 2021-07-05关于举办全省推拿手法“三步三位九法”规范化操作技…
- 2020-09-01关于公布2020年住院医师规范化培训及全科医师规范化…
- 2020-07-28欧宝app下载 2020年住院医师规范化培训招…
-
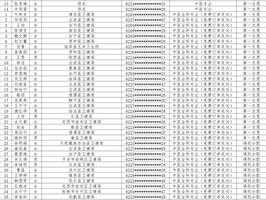
- 2023-05-20欧宝app下载 2023年中医(全科)住院医师…
- 2022-09-09关于公布2022年住院医师规范化培训及全科医师规范化…
- 2022-07-07欧宝app下载 2022年住院医师规范化培训招…
- 2021-08-16关于公布2021年住院医师规范化培训及全科医师规范化…
- 2021-07-06欧宝app下载 2021年住院医师规范化培训招…
- 2021-07-05关于举办全省推拿手法“三步三位九法”规范化操作技…
- 2020-09-01关于公布2020年住院医师规范化培训及全科医师规范化…
- 2020-07-28欧宝app下载 2020年住院医师规范化培训招…